FONTE: Vycma Laboratórios
__
M.V. Tayná C.B. Florio
__
INTRODUÇÃO
Micoplasmas hemotrópicos são bactérias gram-negativas do gênero Mycoplasma que parasitam a superfície dos eritrócitos, causando prejuízos. Em felinos, existem três espécies descritas: Candidatus Mycoplasma haemominutum, Candidatus Mycoplasma turicensis e Candidatus Mycoplasma haemofelis, sendo este último considerado o mais patogênico. As outras duas espécies manifestam-se de maneira mais grave em animais imunossuprimidos. A micoplasmose hemotrópica felina pode apresentar sintomas como febre, letargia e anorexia, sendo a anemia a principal alteração observada, causada por hemólise extravascular ou intravascular.
A transmissão da micoplasmose pode ocorrer através de artrópodes, como pulgas (C. felis) e carrapatos (R. sanguineus), ou de maneira iatrogênica, como transfusão sanguínea. A presença do vírus da leucemia felina (FeLV) pode facilitar a infecção por agentes oportunistas como M. haemofelis, com impacto significativo na coinfecção, sendo os animais jovens os mais suscetíveis.
O diagnóstico da micoplasmose felina é realizado por meio da avaliação dos sinais clínicos e achados hematológicos, sendo confirmado por métodos moleculares, como a reação em cadeia da polimerase (PCR). Este método é considerado o mais específico e sensível, permitindo a diferenciação entre as espécies de Mycoplasma.
O tratamento da doença envolve o uso de antibióticos da classe das tetraciclinas, associado à terapia de suporte, incluindo fluidoterapia e transfusão sanguínea em casos de anemia grave.
__
ETIOLOGIA E EPIDEMIOLOGIA
O micoplasma hemotrópico, inicialmente identificado em roedores, teve seus primeiros relatos na década de 20. Inicialmente classificado no gênero Bartonella devido ao seu tropismo, tamanho e suposta forma de transmissão, posteriormente foi sugerida a classificação para a família Anaplasmataceae, ordem Rickettsiales. O primeiro relato de uma bactéria associada à anemia em felinos ocorreu na década de 1940, inicialmente nomeada como Eperythrozoon felis, sendo internacionalmente reconhecida como Haemobartonella felis após a década de 1970. Em 2001, a bactéria foi reclassificada como membro do gênero Mycoplasma, comumente chamados de hemoplasmas.
Os hemoplasmas são bactérias gram-negativas que parasitam a superfície dos eritrócitos, pertencendo à classe dos Mollicutes, que não possuem parede celular. Encontradas em diversas espécies, como humanos, outros mamíferos, peixes, répteis e artrópodes, essas bactérias podem causar anemia hemolítica em seus hospedeiros infectados.
Três principais espécies de hemoplasmas estão associadas a infecções em gatos domésticos e selvagens: Mycoplasma haemofelis, Candidatus Mycoplasma haemominutum e Mycoplasma turicensis. Mycoplasma haemofelis e Candidatus Mycoplasma haemominutum foram reconhecidas em 2001 através do sequenciamento do gene 16S rRNA, enquanto Candidatus Mycoplasma turicensis foi descrita mais recentemente. Isoladamente, Candidatus Mycoplasma haemominutum e Candidatus Mycoplasma turicensis não estão associadas ao desenvolvimento da doença em felinos hígidos, sendo consideradas patogênicas principalmente em pacientes imunossuprimidos, como na FeLV.
A transmissão dos hemoplasmas felinos ocorre principalmente através de vetores artrópodes, como piolhos, pulgas e carrapatos. Ctenocephalides felis é a espécie de pulga mais frequentemente associada à transmissão. Estudos relatam a presença de hemoplasmas em pulgas coletadas em gatos e fragmentos de DNA de Candidatus Mycoplasma haemominutum em certas espécies de carrapatos, sugerindo-os como possíveis vetores do agente.
A transmissão horizontal durante brigas entre gatos machos adultos e a transmissão vertical de uma fêmea gestante para os filhotes são consideradas formas de contágio. Houve relato de transmissão via transfusões sanguíneas, com o risco dependendo da viabilidade do micoplasma presente na amostra. Estudos indicam que Mycoplasma haemofelis pode ser transmitido quando armazenado por até uma hora em bolsa com anticoagulante CPDA a 4ºC, enquanto Candidatus Mycoplasma haemominutum pode sobreviver por até uma semana nas mesmas condições, embora a transmissão persistente não tenha sido observada.
A transmissão vertical de Mycoplasma haemofelis de uma fêmea gestante com micoplasmose para os filhotes foi descrita mesmo na ausência de artrópodes vetores. Não se sabe se a infecção ocorre “in útero”, no parto ou durante a lactação, devido à falta de estudos que comprovem experimentalmente este modo de transmissão. Gatos machos adultos de vida livre ou semi-domiciliados são considerados grupo de risco para infecção, sugerindo a transmissão horizontal por interação social em brigas. A prevalência de infecção é maior em felinos com histórico de ectoparasitas e em animais imunodeficientes, principalmente naqueles co-infectados por FIV ou FeLV, além de animais esplenectomizados.
__
PATOGENIA
O grau de patogenicidade das espécies de micoplasmas felinos é variável, podendo causar desde sinais clínicos imperceptíveis até anemia hemolítica, especialmente em animais mais jovens devido à imaturidade imunológica. Mycoplasma haemofelis é considerada a mais patogênica, associada a anemia hemolítica regenerativa, enquanto Mycoplasma haemominutum geralmente não causa sintomas em animais imunocompetentes, e Candidatus Mycoplasma turicensis revela potencial patogênico em felinos imunossuprimidos.
A anemia causada por Mycoplasma haemofelis pode ocorrer por lesão direta à membrana celular, induzindo a lise e aumento da fragilidade osmótica, ou de maneira indireta, pela destruição das hemácias pelo sistema mononuclear fagocitário, ou ainda pela apoptose dos eritrócitos infectados. A patogenicidade dessa espécie está relacionada à variabilidade antigênica em sua superfície celular, permitindo a alteração de características de membrana e a evasão do sistema imunológico.
Estudos indicam que a infecção por Mycoplasma haemofelis passa por fases, incluindo uma fase pré-parasitária, uma fase aguda com manifestação de sinais clínicos, uma fase de recuperação com normalização do volume globular e uma fase assintomática em que os animais permanecem portadores dos micro-organismos, podendo apresentar recidivas da doença.
Em alguns felinos infectados por Mycoplasma haemofelis apresentando anemia, foram observados resultados positivos para teste de Coombs e autoaglutinação, indicando a presença de anticorpos anti-eritrocitários que causam destruição imunomediada dos eritrócitos. A maioria dos felinos no estudo desenvolveu esses anticorpos apenas após o surgimento da anemia, sugerindo que a destruição imunomediada foi induzida pela hemólise direta pelos hemoplasmas.
De acordo com Alleman et al. (1999), a infecção por Mycoplasma haemofelis passa por quatro fases:
- Fase pré-parasitária: Ocorre após o organismo do animal ter sido exposto ao microorganismo, mas antes de começar a se reproduzir. Sinais clínicos podem se manifestar logo após este período, mas alguns gatos podem permanecer assintomáticos ou demorar até seis semanas para apresentar sintomas.
- Fase aguda: É o período em que os sinais clínicos são evidenciados. A gravidade e intensidade dos sintomas dependem de vários fatores, como fatores de risco e se o felino é esplenectomizado ou não. Os sintomas podem variar de uma anemia leve até uma anemia hemolítica grave. Nesta fase, os agentes agressores estão presentes na circulação sanguínea.
- Fase de recuperação: Nesta fase, o volume globular começa a normalizar, e os micro-organismos tendem a aparecer menos nos esfregaços sanguíneos.
- Fase assintomática: Os animais não apresentam nenhum sinal clínico, mas são portadores dos micro-organismos. Podem permanecer nesse estado por meses ou anos, mesmo após o tratamento. A relação parasito-hospedeiro parece estar em equilíbrio nesta fase, onde a replicação do microrganismo é equilibrada por sua fagocitose e eliminação do organismo. Embora rara, a recidiva da doença pode ocorrer.
__
SINAIS CLÍNICOS
Apenas metade dos gatos diagnosticados apresentam sintomatologia, enquanto os outros 50% são achados em gatos clinicamente saudáveis durante exames de rotina. A intensidade dos sintomas vai depender da patogenicidade do agente, variação na susceptibilidade do hospedeiro e quantidade de microrganismos inoculada.
A doença pode se apresentar de forma assintomática, causando anemia leve, ou ter sinais como depressão, anorexia, perda de peso, fraqueza, mucosas hipocoradas (pálidas), aumento de baço (esplenomegalia) e icterícia. Os animais acometidos também podem apresentar febre. A esplenomegalia e linfadenopatia presentes em alguns casos se dão devido a uma hematopoiese extra medular. A icterícia acontece por conta da destruição dos eritrócitos.
Pacientes portadores de retroviroses, como FIV e FeLV, estão mais predispostos a desenvolver e manifestar os sinais clínicos, muitas vezes de maneiras ainda mais intensas.
A perda de peso é bastante comum em pacientes cronicamente infectados; normalmente, esses felinos apresentam um tipo de infecção subclínica, podendo manifestar sinais clínicos após situações de estresse e baixa de imunidade.
Podemos citar alguns fatores de risco quando falamos de micoplasmose felina, como idade, gênero, estilo de vida, infecção pré-existente por retroviroses e infecção simultânea por diversas espécies de hemoplasmas.
__
DIAGNÓSTICO
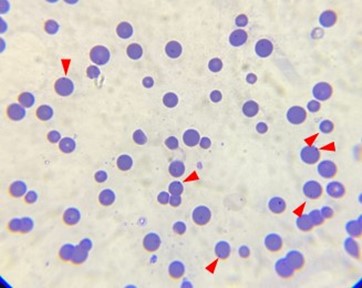
Os métodos utilizados para chegar ao diagnóstico da infecção por Mycoplasma haemofelis são variados. Um deles é a observação do microrganismo em lâminas de esfregaço sanguíneo. Durante a análise do esfregaço sanguíneo, podemos observar nas hemácias pequenas estruturas de coloração basofílica, epieritrocitárias, e de formato cocoide ou estruturas em forma de anel, ou bastonete na superfície dos eritrócitos.
Apesar de ser possível visualizar as bactérias durante a análise do esfregaço sanguíneo, existem muitas fragilidades neste método. A ausência de estruturas compatíveis com Mycoplasma spp não exclui a possibilidade de diagnóstico positivo para micoplasmose. Existem muitos fatores que podem causar uma imprecisão citológica quando falamos sobre a pesquisa de Mycoplasma spp. Desta forma, este método não é o padrão ouro aceito para o diagnóstico.
Segundo estudo realizado em 2010, foram avaliados pacientes quanto à presença de estruturas compatíveis com Mycoplasma spp., 58 felinos de um abrigo e 57 felinos possuindo tutores, todos eles clinicamente saudáveis. Foi observada a presença de micoplasmas hemotrópicos em apenas 11% dos animais com resultados positivos no PCR de sangue periférico.
Para o diagnóstico de Mycoplasma haemofelis, o método de eleição é o RT-PCR (realtime polymerase chain reaction). Quando executado da maneira correta, este teste possui excelente sensibilidade e especificidade, permitindo inclusive diferenciar as espécies de micoplasmas hemotrópicos.
Os felinos que apresentarem PCR negativo em um primeiro momento podem apresentar resultados positivos após o término do tratamento com antibiótico. Desta forma, apenas um resultado negativo não é suficiente para afirmar que o paciente não está mais parasitado. O aconselhável é que seja realizado PCR de três amostras distintas, colhidas a cada trinta dias. A sequência de resultados negativos aumenta a probabilidade de que a eliminação da bactéria tenha realmente ocorrido. Além disso, um PCR positivo não significa que a infecção está ativa, pois esses felinos podem se tornar portadores sem a manifestação de sintomatologia clínica. Por este motivo, os resultados de PCR devem ser sempre associados aos sinais clínicos apresentados pelo paciente.
A babesiose felina e a cytauxzoonose devem ser incluídas no diagnóstico diferencial da micoplasmose por possuírem sinais clínicos semelhantes, principalmente na fase aguda da doença. Além disso, outras causas de anemia hemolítica devem ser avaliadas, como intoxicação por diferentes agentes ou drogas e anemias hereditárias (comum nas raças Abssínios e Somali). A PIF (peritonite infecciosa felina) também deve ser considerada como diagnóstico diferencial, principalmente em sua fase inicial, devido aos sinais clínicos inespecíficos, semelhantes à infecção por Mycoplasma haemofelis.
__
TRATAMENTO
Alguns autores recomendam seguir o protocolo de tratamento para micoplasmose em todos os felinos que apresentem anemia hemolítica regenerativa sem causa de base determinada, devido à dificuldade de diagnóstico da doença. No entanto, outros autores relatam que pacientes que não manifestam sinais clínicos, mesmo com resultado positivo em PCR, não devem ser tratados, haja vista que felinos que já fizeram tratamento para micoplasmose podem apresentar PCR positivo durante toda a vida sem ter a doença.
Pacientes com anemia intensa provocada por hemoplasmas podem tornar-se animais vulneráveis e necessitar de cuidados intensivos, devido à evolução do quadro anêmico e comprometimento do sistema cardiovascular. O tratamento para micoplasmose pode apresentar bons resultados com o uso de antibioticoterapia e terapia suporte, quando diagnosticada corretamente.
Fármacos do grupo das tetraciclinas e fluorquinolonas são os antibióticos utilizados com maior frequência na rotina clínica. São os mais eficazes na redução do número de microrganismos na circulação, o que promove uma melhora significativa nos sinais clínicos e laboratoriais, mesmo que a eliminação completa bactéria ainda não tenha sido comprovada em nenhum estudo.
A doxiciclina é a tetraciclina de eleição para os felinos, devido aos seus efeitos colaterais se apresentarem de maneira menos significativa quando comparadas às demais tetraciclinas na espécie. Embora alguns estudos recomendem a utilização de 10 mg/kg, via oral, a cada 24 horas durante 14 a 21 dias, estudos mais recentes relatam que gatos experimentalmente infectados por Mycoplasma haemofelis obtiveram maior eficácia no tratamento com a utilização de doxiciclina 5 mg/kg, via oral, a cada 12 horas, no período de 21 a 28 dias, devido à meia vida e tempo de ação do medicamento no metabolismo da espécie.
Uma segunda opção de antibioticoterapia se dá pelo uso da enrofloxacina, na dose de 5 mg/kg a cada 24 horas, via oral, durante 14 dias, principalmente para utilização em gatos que se apresentaram intolerantes de alguma forma à doxiciclina. Todavia, é necessário cuidado com a administração deste fármaco, haja vista que estudos relatam o aparecimento de cegueira súbita em felinos em tratamento com enrofloxacina. A utilização de marbofloxacino, na dose de 2 mg/kg a cada 24 horas, via oral, durante 28 dias também demonstra bons resultados e não foram relatados efeitos adversos oculares relacionados ao uso deste fármaco.
Como terapia suporte, a fluidoterapia pode ser realizada quando o animal apresentar algum nível de desidratação. A hipovolemia pode, inclusive, alterar os resultados hematológicos do paciente, mascarando a gravidade da anemia. É importante que a alimentação seja estimulada através de alimentos mais palatáveis ou até mesmo alimentação forçada, embora seja comum que a anorexia tenha curta duração e o apetite retorne ao normal após o início do tratamento.
A transfusão sanguínea nem sempre é recomendada, devendo ser utilizada em casos onde o paciente apresente anemia severa (HCT <12%) e com sinais clínicos decorrentes de descompensação. Nestes casos é imprescindível a realização de teste de compatibilidade, a fim de diminuir os riscos de reações transfusionais. O volume indicado para transfusão é de 8 a 12 mL/kg, na velocidade de 1 mL por minuto.
A utilização de corticoides no tratamento de micoplasmose não obteve comprovação em sua eficácia quando utilizadas em felinos com anemia. Além disso, em um estudo com felinos infectados por Candidatus Mycoplasma turicensis, o paciente que recebeu acetato de metilprednisolona desenvolveu sintomas mais severos de anemia do que o felino imunocompetente. Logo, a utilização de corticoides é recomendada apenas em casos onde os tratamentos anteriores não apresentam sucesso devido à anemia hemolítica imunomediada (AHIM).
É importante ressaltar que pacientes que foram tratados para a infecção por Mycoplasma spp. e com ausência de sinais clínicos podem tornar-se portadores assintomáticos por tempo indeterminado. No entanto, pode-se realizar o monitoramento da doença com testes de PCR após uma ou duas semanas a partir do início do tratamento, onde resultados negativos são o método mais confiável para indicar a eliminação do agente.
__
PREVENÇÃO
O combate a ectoparasitas, como pulgas e carrapatos, é uma das medidas mais importantes no controle e prevenção da micoplasmose. Além disso, gatos 100% domiciliados (sem acesso à rua) têm menores chances de serem acometidos.
Estudos demonstram que pacientes positivos para FeLV estão mais predispostos a desenvolverem a doença. Sendo assim, o diagnóstico das retroviroses, bem como a vacinação contra a FeLV, possui grande importância no controle da micoplasmose.
Também é indispensável que não haja a reutilização de agulhas e seringas ou objetos contaminados com sangue, que possam atuar como fômites, além de testagem prévia em animais doadores de sangue através da técnica de PCR.
__
REFERÊNCIAS
BARKER, E. Update on Feline Hemoplasmosis. Veterinary Clinics of North America: Small Animal Practice, v. 49, p. 733 – 743, 2019.
COELHO, P.; ANGRIMANI, D.; MARQUES, E. Micoplasmose em felino domestico: Revisão de literatura. Revista Cientifica Eletronica de Medicina Veterinaria, Janeiro 2011.
FOLEY, J. et al. Molecular, clinical, and pathologic comparison of two distinct strains os
Haemobartonella felis in domestic cats. American Journal of Veterinary Research, v. 59, n. 12, p. 1581 – 1588, 1998.
FOLEY, J.; PEDERSEN, N. Candidatus Mycoplasma haemominutum’, a lowvirulence
epierythrocytic parasite of cats. International Journal of Systematic and
Evolutionary Microbiology, v. 51, n. 3, p. 815 – 817, maio 2001.
GEORGE, J.W. Effect of preexisting FeLV infection or FeLV and feline immunodeficiency
virus coinfection on pathogenicity of the small variant of Haemobartonella felis in cats.
American Journal of Veterinary Research, v. 63, p. 1172 – 1178, agosto 2002.
GREENE. Doencas Infecciosas em Caes e Gatos. 4. ed. [S.l.]: Roca, 2015. 1404 p.
HAGIWARA, M. Anemia. In: JUSTEN, H. (Ed.). Coletanea em medicina e cirurgia felina.
Rio de Janeiro: L.F. Livros, 2003. p. 15 – 20.
MESSICK, J.; HARVEY, J. Hemotropic Mycoplasmosis (Hemobartonellosis). In: GREENE,
C. (Ed.). Infectious Diseases of the Dog and Cat. 4. ed. [S.l.]: Elsevier, 2011.
MESSICK, J.B. Hemotrophic mycoplasmas (hemoplasmas): a review and new insights into pathogenic potential. Veterinary Clinical Pathology, v. 33, p. 2 – 13, 2004.
NEIMARK, H. et al. Proposal to transfer some members of the genera Haemobartonella
and Eperythrozoon to the genus Mycoplasma with descriptions of ‘Candidatus
Mycoplasma haemofelis’, ‘Candidatus Mycoplasma haemomuris’, ‘Candidatus Mycoplasma haemosuis’ and ‘Candidatus Mycoplasma wenyonii’. International Journal of Systematic and Evolutionary Microbiology, v. 51, p. 891 – 899, 2001.
NEIMARK, H. et al. Revision of haemotrophic Mycoplasma species names. International Journal of Systematic and Evolutionary Microbiology, v. 52, p. 683 –, março 2002.
QUINN, P. et al. Veterinary Microbiology and Microbial Disease. 2. ed. [S.l.]:
Wiley-Blackwell, 2011. 928 p.
RAMNSEY, I.; TENNANT, B. Manual de Doencas Infecciosas em Caes e Gatos. 1. ed.
[S.l.]: Roca, 2010. 320 p.
ROURA, X. et al. Prevalence of hemotropic mycoplasmas in healthy and unhealthy cats and dogs in Spain. Journal of Veterinary Diagnostic Investigation, v. 22, n. 2, p. 270 – 274, 2010.
SANTOS, A. et al. Prevalencia de hemoplasma e alteracoes hematologicas associadas
a infeccao em tres diferentes populacoes de gatos do Sul do Brasil. Revista
Brasileira de Parasitologia Veterinaria, v. 23, p. 428 – 434, 2014.
TASKER, S. Haemotropic mycoplasmas: what’s their realsignificance in cats? Journal
of Feline Medicine and Surgery, v. 12, p. 369 – 381, maio 2010.
TASKER, S. et al. Effect of chronic feline immunodeficiency infection, and efficacy of
marbofloxacin treatment, on ’Candidatus Mycoplasma haemominutum’ infection. Microbes and Infection, v. 8, p. 653 – 661, 2006.
TASKER, S.; LAPPIN, M. Haemobartonella felis: recent developments in diagnosis and
treatment. Journal of Feline Medicine and Surgery, v. 4, p. 3 – 11, março 2002.
WILLI, B. et al. Prevalence, risk factor analysis, and follow-up of infections caused by three feline hemoplasma species in cats in Switzerland. Journal of Clinical Microbiology, v. 44, p. 961 – 969, 2006.
WILLI, B. et al. . Identification, molecular characterization, and experimental transmission of a new hemoplasma isolate from a cat with hemolytic anemia in Switzerland. Journal of Clinical Microbiology, v. 43, p. 2581 – 2585, junho 2005.
WOODS, W. et al. Evaluation of experimental transmission of Candidatus Mycoplasma
haemominutum and Mycoplasma haemofelis by Ctenocephalides felis to cats. American Journal of Veterinary Research, 2005.